POSSIBILIDADES DE UM CIMENTO ÓSSEO RADIOATIVO EM
METÁSTASES ÓSSEAS - UMA REVISÃO
Carlos Julio Montaño (MSc, doutorando), Tarcisio Passos Ribeiro de Campos (Prof. Titular, PhD)
Universidade Federal de Minas Gerais - UFMG
Dpto. de Engenharia Nuclear – Laboratório Núcleo de Radiações Ionizantes
carlmont@ucm.es, tprcampos@yahoo.com.br
Endereço: Escola de Engenharia, Depto. Eng. Nuclear, Bloco 4, Sala 2285,
Av. Antônio Carlos, 6627, CEP 31270-901, Belo Horizonte-MG / Brasil
Tel: 31-34096691, 998331961
Agradecimentos: Os autores agradecem o suporte financeiro da CAPES, do projeto REBRAT-SUS, apoiado pelo CNPq.
Março de 2018
Sobre a Vertebroplastia
Em 1998, Deramond torna pública uma técnica cirúrgica que, atualmente, é conhecida como vertebroplastia, vocábulo cujo radical plastia significa "processo cirúrgico destinado a reparar ou restaurar um órgão" (HOUAISS et al, 2009). Neste caso vertebroplastia é a restauração de uma vértebra.
A técnica de Deramond utiliza polimetilmetacrilato (PMMA) acrescido de contraste radiológico. O produto é injetado no corpo vertebral para recuperar a estrutura e a solidez do osso.
É empregado nos casos de osteoporose e fraturas severas do corpo vertebral mas, é contraindicado quando a lesão é de origem metastática porque não atua na erradicação de células cancerosas (DERAMONT, et al. 1998).
A vertebroplastia é um procedimento minimamente invasivo usado para tratamentos de patologias ósseas na ortopedia. O uso de dos cimentos ósseos auxilia na cola de peças e estabilização da coluna vertebral. A cifoplastia melhorou o procedimento da vertebroplastia porque também restaura anatomicamente a peça óssea e sua funcionalidade, quando já colapsada, sendo que neste caso um balão infla internamente a estrutura colapsada antes da inserção do cimento. Assim, a vertebroplastia se estabeleceu como uma técnica para atender pacientes com compromisso neurológico produzida pela compressão da medula espinhal.
Vertebroplastia e Oncologia
Não há indicação de aplicação da vertebroplastia em corpos de vértebras com metástasis que mantêm intacta sua estrutura óssea. Entretanto, é possível o uso de vertebroplastia quando há fraturas severas induzidas pelo câncer. Quando estas ocorrem, podem levar ao aprofundamento do corpo da vértebra produzida pela invasão de células cancerosas. Neste caso, a vertebroplastia é aplicada em vértebras que podem ou sofreram colapso com o comprometimento estrutural do corpo vertebral. Assim, a vertebroplastia, ou a cifoplastia, produz o restauro da estrutura vertebral colapsada, descomprimindo a medula (FOURNEY, et al., 2003). Entretanto, de forma alguma tal técnica atua da erradicação das células cancerosas que agem no sitio vertebral. O calor gerado pela reação exotérmica do PMMA pode ser benéfico em esterilizar as ramificações nervosas internas, e consequentemente reduzir a dor, mas não é suficiente e demonstrável que pode erradicar células cancerosas.
Em verdade, a falha na vertebroplastia aplicada em tumor da coluna vertebral colapsada tem sido um problema encontrado na clínica médica, por exemplo. A vertebroplastia pode produzir resultados favoráveis nas primeiras semanas, entretanto com o tempo a condição clinica é deteriorada pela expansão das metástases. (VIRTO et al, 2003; GUERRA, et ali, 2010; PENA e VALLET-REGI, 2003)
Figura 1 – Imagens radiográficas de corpo de vértebra com indicativo para vertebroplastia, com metástases interna.
(A) no diagnóstico – complementado com RMN e Cintilografia; (B) vertebroplastia aplicada e radioterapia externa;
(C) falha com colapsamento da vertebra. Fonte: D´Alessandro, 2005.
Radiografias da coluna de um paciente, submetido a vertebroplastia em condição de metástasis e fratura severa, mostraram que a estrutura residual óssea após-vertebroplastia apresenta inexistente e que o corpo da vértebra ficou resumido ao cimento acrílico injetado. Na Figura 1(A) pode-se observar fratura na vértebra, induzida por metástasis certificada por outras técnicas de diagnóstico. A Figura 1(B), mostra o status do corpo da vértebra após vertebroplastia, com aumento da densidade radiográfica na periferia do corpo cimentíceo acrílico (PMMA) mostrando deslocamento de conteúdo interno para periferia entre o osso cortical e a superfície do bloco de cimento acrílico. Após 6 meses, Figura 3(C), pode-se identificar colapso da vértebra, e perda de estrutura óssea no entorno do cimento acrílico e regiões totalmente ausentes de osso estrutural. (MACEDO, 2005)
Pode-se observar que ao aplicar a vertebroplastia, o conteúdo interno hidrofílico foi deslocado pelo cimento hidrofóbico para a periferia, que acelerou o processo de expansão tumoral e deterioração da estrutura óssea restante (MACEDO, 2005) (WEILL, et all 1996).
Uma vez injetado no interior da vertebra, o PMMA difunde-se pela estrutura fraturada ocupando o espaço que foi gerado pela expansão das células cancerosas no corpo da vértebra. Por ser hidrofóbico e aplicado em um tempo curto, não há a possibilidade do composto hidrofóbico se misturar à solução aquosa e celular presente no corpo vertebral. O conteúdo canceroso então é deslocado com a infusão do composto hidrofóbico para sua periferia. Parte pode ser removida com uma segunda cânula de descompressão (técnica empregada atualmente), mas grande quantidade de células é deslocada para a periferia do corpo restante da vértebra e permanece in situ. Durante a pega (endurecimento), reações exotérmicas não controláveis podem ajudar em atenuar as células, mas não eliminam a invasão cancerosas. As temperaturas de pico da reação exotérmica dependem da quantidade de material injetado e do tempo de pega do acrílico. A distribuição de temperaturas é função da distância ao centro da fonte, o que causa um gradiente variável no tempo com valores menores que 45oC, um valor necessário para esterilização (COSTA e CAMPOS, 2008; HOSONO et al., 1995). Desta forma, após algum tempo, as células em seu novo ambiente, através de seu processo mitótico expansionista, desenvolvem angiogênese e continuam a evoluir microfraturando a estrutura óssea restante da periferia. Células osteoclásticas e osteoblásticas misturadas perderam a homeostasis quando o osso foi comprimido e fraturado, e o balanço pode favorecer a absorção óssea pelas células osteoclásticas. Então, a compressão faz com que os osteoclásticos consumam o osso. As próprias células cancerosas podem também encontrar em tais resíduos o nutriente favorável a sua evolução (DALBY, et all 2002).
A Vertebroplastia e a Radioterapia
A vertebroplastia é aplicada em fraturas extensas para dar sustentação mecânica e reduzir a dor induzida pela fratura. Por sua vez, as vértebras acometidas de metástases podem colapsar e produzir fraturas severas. A vertebroplastia pode ser empregada para recuperar a estrutura da vertebra, ou através do PMMA acrílico direto ou em um balão expansor definido pela cifloplastia. (KLIMO e SCHMIDT, 2004) Neste caso especifico, o dano estrutural da vertebra ocorreu devido ao câncer, e a vertebroplastia deve ser seguida pela radioterapia para casos específicos.
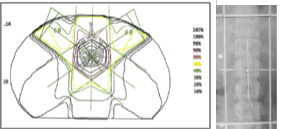
A vertebroplastia e a radioterapia são conceitos e técnicas distintas. Na figura 2 pode-se observar o protocolo clinico da teleterapia megavoltagem na irradiação do corpo da vertebra (CASTRO, et al., 2002). No caso, não se irradia uma única vertebra, mas um campo que incorpora uma porção da coluna vertebral com o envolvimento do corpo da vértebra e da medula espinhal, bem como as grandes artérias que cruzam a região (KLIMO e SCHMIDT, 2004) Há sequelas graves agudas e tardias associadas a irradiação de parcela da coluna vertebral. As tardias podem levar o paciente a paralisia dos membros. Entretanto, possivelmente aceitável pela curta expectativa de vida do paciente oncológico. No caso, utiliza-se duas ou três janelas transversais que são combinadas para expor a vertebra às doses clinicas, em regime fracionado. O PMMA com bário, injetado na vertebroplastia, é um forte absorvedor de raios-X, e consequentemente altera a distribuição das doses absorvidas no campo de irradiação devido a forte heterogeneidade presente. O cimento contrastado absorve e faz sombreamento da dose faceando a superfície do bloco cimentíceo e a interface com sítio metastático. Efeitos de heterogeneidade, produzida pela composição dos cimento no corpo da vertebra, muitas vezes não são levados em consideração na dosimetria (TURNER, et al., 2008).
Figura 2 – Distribuição de isodoses produzidas por três campos de irradiação, proposto no planejamento radioterápico,
e dimensões do campo externo centrado na vertebra alvo (CASTRO, et al., 2002), Fonte: modificado de
A Figura 2 ilustra padrões de irradiação do corpo da vertebra com metástasis, em situação clínica específica. Em radioterapia de corpo da vertebra, a radiação expõe a coluna vertebral a altas doses absorvidas (KLIMO e SCHMIDT, 2004; VAN DER LINDEN et al, 2005).
O efeito tardio da radioterapia de coluna é a mielopatia que pode se desenvolver após radioterapia para tumores perto ou na coluna vertebral. Essa doença provoca fraqueza, perda de sensibilidade e leva a síndrome de Brown-Séquard. Nessa síndrome, um lado da medula espinhal fica lesionado, originando fraqueza no corpo e perda da sensibilidade à dor e à temperatura. O paciente pode perder a habilidade de saber a posição das mãos e dos pés, perdendo a capacidade de se mover com coordenação (KLMO e SCHMIDT, 2004). A mielopatia radioinduzida, efeito tardio, não pode ser revertida e usualmente conduz a uma perda de movimento (RYU et al., 2007)
Novo Material e suas Perspectivas
Questiona-se o que pode ser empregado para combater células metastáticas deslocadas para a periferia do cimento acrílico, na interface osso residual - superfície aleatória difusa do PMMA. A solução pode estar em um cimento completo, com diversos agregados, como hydroxiapatita, onde um constituinte radioativo deve ser incorporado à estrutura cristalina da hydroxiapatita. Assim, independente da forma difusa que o cimento assume ao ser injetado e difundido na estrutura fraturada, sua superfície aleatória tomada será radioativa emissora de partículas betas de curto alcance. Neste caso, exatamente na superfície onde células cancerosas foram deslocadas e promovem angiogênese, há uma alta exposição à radiação, confinada pelo curto alcance das partículas nucleares na estrutura. Esta foi a proposta apresentada pelo grupo de pesquisa NRI – Nucleo de Radiações Ionizantes da UFMG (CAMPOS e MACEDO, 2006; MACEDO e CAMPOS, 2005)
Um cimento radioativo ósseo tem condição de resolver a eliminação das células residuais cancerosas, deslocadas pelo cimento PMMA empregado pela vertebroplastia, cuja técnica provocou o acumulo destes depósitos residuais cancerosos na periferia da interface cimento acrílico – corpo cortical (CAMPOS e MACEDO, 2006; DONANZAM et al, 2013). Além, o cimento ósseo radioativo não induz heterogeneidade da dose e expõe o entorno de sua borda com dose homogênea. A teleterapia megavoltagem passa a ser co-adjuvante após a aplicação do cimento radioativo ósseo com reduzida dose na medula; e, as doses no corpo da vértebra passam a ser elevadas e curativas.
O cimento radioativo pode ser aplicado em uma única seção. O decaimento do radioisótopo é de meia vida curta como Sm-153 (48h) ou Ho-166 (26h), e deposita toda a dose em um período de seis meias vidas. É de se esperar diferenças significativas das consequências clínicas entre a teleterapia de megavoltagem e a aplicação do produto definido pelo NRI.
O cimento ósseo radioativo poderá ser aplicar em situações clinicas de metástases, exclusivamente, sendo totalmente contraindicado para osteoporoses onde a vertebroplastia com cimento acrílico tem indicação. O produto pode ser aplicado mesmo onde a estrutura óssea não tenha grandes fraturas, ou que a coluna não esteja comprimida, ou que o corpo da vertebra não esteja colapsado, ou que a função não seja a recuperação da estrutura óssea. Fora das indicações da vertebroplastia, o cimento radioativo pode ser aplicado em toda a estrutura óssea, independente das dimensões das trabéculas ósseas (CAMPOS e MACEDO, 2006; CARDOSO et al, 2009; DOROZHKIN, 2009).
O procedimento favorável produzido pelo cimento ósseo radioativo proposto, agora não mais ficou restrito à vértebra, e não exatamente a vertebroplastia. Pode ser aplicado aos diversos corpos ósseos, incluindo áreas muito sensíveis como as costelas, quando há metástases e infiltrações de câncer de mama, mesmo na periferia do pulmão. Por exemplo, pode ser aplicado em metástases na calota craniana, mesmo a alguns milímetros do córtex cerebral do paciente, sem perspectiva de dano algum neurológico.
Constituição do Cimento Ósseo Radioativo
A Figura 4 apresenta imagens estereoscópicas do cimento radioativo ósseo preparado com razões de proporcionalidades em peso extremas, isto é, com mínima quantidade de HAp (máximo PMMA), e de máxima quantidade de HAp (mínimo PMMA). Foi observado que em ambas a situações, os compostos puderam ser misturados e ocorreu pega. A fluidez do composto é maior se PMMA é maior, e menor se a concentração de HAp é maior. Entretanto ambos são de interesse e tem praticidade e aplicabilidade. Em volumes grandes, ou em cavidades ósseas, como nasofaringe, fêmur, ou em cirurgias ortopédicas abertas é possível aplicar ou depositar cimento ósseo radioativo com máxima proporção de HAp; enquanto, para ossos muito finos, como costelas, ossos da mão e pé, é necessária uma concentração de HAp muito baixa.
Figura 4 – Imagens esteroscopicas (x80) do cimento radioativo ósseo, frio, após preparo e pega, com razão
de concentração entre polimetilmetacrilato e hidroxiapatita, incorporando Ho-165 em sua matriz de
Ca e P, de 1:0,01 e 0,1:1, isto é de 100x para 0,1x. Fonte: acervo do autor.
Assim a razão de proporcionalidade entre o ligante e o agregado é assintóticamente representada por 1:0, e 0:1. Obviamente 0 (nulo) não é assumido porque foge ao escopo de um cimento por não haver HAp incorporando radioisótopo; ou apenas HAp sem ligante.
Ativação do Cimento Ósseo
A atividade do radionuclídeo preconizada no agregado depende do fluxo de neutrons do reator em uso. O compósito cimento ósseo radioativo pode aplicado em diversas cavidades, estruturas trabeculares, em condição de metástases ou em infiltrações de tumores que evoluem para as cavidades ósseas. Os volumes são amplos e a quantidade do cimento radioativo aplicado é da órdem de 10-6g a 300 gramas, ou mais, dependendo da anatômica desenvolvida pela presença do tumor ou metástases.
Em relação a atividade, a ativação neutrônica depende das seções de choque de nêutrons da material base, constituído de C, H, Ca, P e do metal M, por exemplo samário. O Sm tem seção de choque de abosorção de nêutrons de 40.000 b (b=10-24cm2), enquanto o fosforo (P) tem seção de choque de 10-3b, e Ca variando conforme o isótopo chega a 0,1b, baixo o suficiente tal que qualquer contaminação radioisotópica seja aceitável (DONANZOM et al, 2013; HISCH et al, 2008). Com seções de choque tão altas do radionuclídeo, atividades de Bq a dezenas de MBq podem ser produzidas. A ativação dependerá do fluxo de nêutrons do reator, da massa do composto, do volume, das seções de choque e do tempo de irradiação. A formação matemática para equacionar a atividade pode ser obtida na literatura (DONANZAM et al, 2003). Mesmo em massas de agregados (HAp) muito pequenas na ordem de microgramas, ou na ordem de dezenas de gramas, é possível ativar o composto o suficiente para produzir uma eliminação das células cancerosas a 1-2 mm da superfície do bloco do cimento ósseo radioativo, após pega in-situ.
As múltiplas emissões de raios betas dos radionuclideos inseridos na HAp produzem para cada decaimento energia na ordem 1 a 1.8MeV (dependendo do radionuclídeo escolhido), que são depositadas em uma massa reduzida, equivalente ao volume de 1-3 mm no entorno do cimento radioativo. A razão entre energia depositada e massa fornece o conceito de dose absorvida (Gy = J/kg). Consequentemente há a expectativa de que a dose absorvida no entorno do cimento ósseo seja muito elevada, porque a energia (J) é alta e a massa (kg) é muito pequena. A massa é limitada devido ao percurso reduzido das betas emitidas pelo radionuclídeos no cimento. Assim, doses clínicos de 20 a 140 Gy são facilmente obtidos com baixas atividades do cimento radioativo. (SILVERIA, 2007; DONANZOM et al, 2013) Haverá sempre uma proporção de agregado e ligante, uma atividade e uma massa que atente a uma dose absorvida que possa eliminar as células cancerosas na periferia do bloco solidificado do cimento ósseo radioativo.
Dosimetria no Cimento ósseo Radioativo
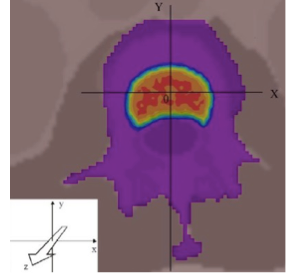
A distribuição da irradiação produzida pelo cimento ósseo radioativo pode ser vista em imagem apresentada na Figura 5. (DONANZOM et al, 2013). No caso clinico do cimento ósseo radioativo, a possibilidade de anular a dose a alguns milímetros da fonte, evitando a irradiação dos órgãos vitais adjacentes, ultrapassa as expectativas da teleterapia de megavoltagem. Assim, ainda não há estudos de limites de atividade para que produzam uma dose preconizada no emprego do cimento ósseo radioativo.
Nesse modelo de fantoma de vértebra, elaborado computacionalmente nos codigos MCNP5 e SISCODES, o cimento radioativo acoplado com 166Ho apresenta um melhor desempenho terapêutico em razão da diminuição da dose na medula espinhal em comparação com protocolo de RT megavoltagem, como apresentado na Fig.2 (DONANZAM, 2012). A simulação foi feita considerando 1 mg do cimento com uma atividade específica de 32,5 MBq de 166Ho e para obter uma BED no tumor de 72 Gy é necessário que o cimento de 166Ho alcance uma atividade específica de 24,9 MBq.
Figura 5 - (a) Distribuição de dose produzida pelo cimento ósseo radioativo posicionado ao lado da coluna
vertebral; (b) deposição de energia em função do tempo do decaimento do radionuclideo M incorporado
na Hidroxiapatita (DONANZAM, 2012).
A Tabela 1 resume comparativamente as vantagens dosimétricas do uso do cimento radioativo, já que teoricamente a dose na medula espinhal é 10 vezes menor em comparação com a radioterapia megavoltagem externa garantindo uma redução de dose na medula e diminuindo o comprometimento neurológico. Também é relativamente fácil observar que o fraccionamento no caso da terapia com a Radiovertebroplastia acontece em um período de 7 dias, o que tecnicamente nos termos de dosimétrica corresponderia a um tratamento hipofracionado.
Considerações Finais
Pesquisas em situações clinicas oncológicos de pacientes com metástases ósseas ainda continuam sendo necessária no intuito de melhorar a resposta dos cuidados paliativos. Embora o uso de medicamentos para tratar o dor se torna eficaz, as terapias de radiação são usualmente aplicadas devido a disponibilidade dos recursos e a presença de uma resposta paliativa favorável.
No caso dos pacientes oncológicos, com metástases ósseas no corpo da vértebra, terapias de radiação otimizadas por procedimentos como IMRT e 153Sm-EDTMP (ethylene diamine tetramethylene phosphonate) injetado na forma sistêmica têm ampliado a resposta clínica ao tratamento.
Nossa proposta de um cimento ósseo radioativo tem mostrado vantagens significativas em termos dosimétricos. Entretanto o produto carece de avaliação clínica. Pesquisas atuais no NRI abordam a otimização dos componentes do cimento para aumento da bioatividade, diminuição da citotoxicidade e ampliação da produção de poros para melhorar a osteoconductividade e a adesão do complexo celular nos tecidos ósseos.
As metástases óssseas induzem a transtornos fisiológicos, imunológicos, estruturais e neurológicos, in situ. Uma possibilidade apresentada é a radioterapia produzida pelos radioisótopos incorporados na HAp do cimento ósseo radioativo, estabelecido in situ. Posterior a total deposição da energia ionizante, um cimento com características do tecido trabecular pode auxiliar na recuperação da homeostases das células ósseas naturais, podendo auxiliar no processo de restauração natural dos ossos deteriorados. Além, a incorporação de possíveis componentes bioquímicos de sinalização que permitam corrigir o desbalanço celulares do osso podem ser também fonte de pesquisa.
Referências
AMAR, Arun Paul, Donald W. LARSEN, Nasrin N.P. ESNAASHARI, Felipe C. ALBUQUERQUE, Sean D. LAVINE, and George P. TEITELBAUM. "Percutaneous Transpedicular Polymethylmethacrylate Vertebroplasty for the Treatment of Spinal Compression Fractures." Neurosurgery 49, no. 5 (November 2001): 1105-1115.
ASHAMALLA, Hani, et al. “Phase I trial of vertebral intracavitary cement and Samarium (VICS): Novel technique for treatment of painful vertebral mastatasis.” Int. J. Radiation Oncology Biol Phys 75 (2009): 836-842.
CAMPOS, T. P. R.; MACEDO, R. A. . Compósito Radioativo Ósseo - PI0605721-7. 2006.
CARDOSO, Erico R., et al. “Percutaneous tumor curettage and interstitial delivery of Samarium-153 coupled with kyphoplasty for treatment of vertebral metastases.” J Neurosurg Spine 10 (2009): 336-342.
CASTRO, Douglas G., et al. “Hemangioma vertebral sintomático tratado com radioterapia exclusiva - relato de caso e revisão da literatura.” Radiologia Brasileira 35, nº 3 (2002): 179-181.
COSTA, I. T. ; Campos, T. P. R.. Investigação do Perfil Térmico de Cimento Ósseo para Radiovertebroplasita. In: 21 Congresso Brasileiro de Engenharia Biomedica, 2008, Salvador. Anais do 21 CBEB2008. Rio de Janeiro: SBEB, 2008. v. 1. p. 1-5.
DALBY, M. J., L. DI SILVIO, E.J. HARPER, e W. BONFIELD. “Increasing hydroxyapatite incorporation into poly(methylmetacrylate) cement increases osteoblast adhesion and response.” Biomaterials 23 (2002): 569-576.
DERAMOND, Hervé, Claude DEPRIESTER, Pierre GALIBERT, and Daniel LE GARS. "Percutaneous vertebroplasty with polymethylmetacrylate, technique, indications and results." RADIOLOGIC CLINICS OF NORTH AMERICA 36 (1998): 533-546.
DONANZAM, Blanda A., Tarcísio P.R. CAMPOS, Ilza DALMÁZIO, and E. S. VALENTE. "Synthesis and characterization of calcium phosphate loaded with Ho-166 and Sm-153: a novel biomaterial for treatment of spine metastases." J Mater Sci: Mater Med 24 (2013): 2873-2880.
DONANZAM, Blanda Alves. Biocerâmicas com Ho-166 e Sm-153: síntese, caracterização e avaliação dosimétrica em Radiovertebroplastia. Edição: Universidade Federal de Minas Gerais. Vol. Dissertação. Belo Horizonte, Minas Gerais: UFMG, 2012.
DOROZHKIN, Sergey V. “Calcium orthophosphates in nature, biology and medicine.” Materials 2 (2009): 399-498.
FINLAY, Ilora G., Malcolm D. MASON, e Mike SHELLEY. “Radioisotopes for the palliation of metastatic bone cancer: a systematic review.” Lancet Oncol 6 (2005): 392-400.
FOURNEY, Daryl R., et al. "Percutaneous vertebroplasty and kyphoplasty for painful vertebral body fractures in cancer patients." J Neurosurgery (Spine 1) 98 (2003): 21-30.
GUERRA, Nayrim B., Mónica L. HERNÁNDEZ, y Ramón G. SANTOS. «Cementos Oseos Acrílicos Modificados con Hidroxiapatita/Acetato de Vinilo. Caracterización Mecánica, Termoanlítica y Bioactividad In Vitro.» Polímeros 20, nº 2 (2010): 98-106.
HARRINGTON, K. D. “The use methylmetacrylate for vertebral-body replacement and anterior stabilization of pathological fracture-dislocations of the spine to due metastatic malignant disease.” J Bone Joint Sur Am 63 (1981): 36-46.
HIRSCH, Ariel E, David C MEDICH, Barry S. ROSENSTEIN, Christopher B MARTEL, e Joshua A HIRSCH. “Radioisotopes and vertebral augmentation: dosimetric analysis of a novel approach for the treatment malignant compression fractures.” Radioisotope dosimetry 87 (2008): 119-126.
HOSONO, N., K. YONENOBU, T. FUJI, S. EBARA, K. YAMASHITA, e K. ONO. “Orthopedic Management of Spinal Metastases.” Clin Orthop Relat Res. 312 (1995): 148-159.
HOUAISS A., VILLAR M. S., "Dicionário Houaiss da língua portuguesa. 1.ed. Rio de Janeiro: Objetiva, 2009.
KANCKO, T. S., V. SCHGAL, H. B. SKINNER, M.S. A.L. AL-GHAZI, N. S. RAMISINGHANI, e J. H. KEYAK. “Evaluation of a radiation transport modeling method for radioactive bone cement.” Phys Med Biol 55 (2010): 2451-2463.
KLIMO, Paul, e Jr. Meic H. SCHMIDT. “Surgical Management of Spinal Metastases.” The Oncologist 9 (2004): 188-196.
MACEDO, R. D. ; Campos, T. P. R. . Radiovertebroplastia para Tratamento de Metástases Ósseas da Coluna Vertebral. In: International Nuclear Atlantic Conference - INAC2005, 2005, Santos. Anais do 2005 International Nuclear Atlantic Conference. Rio de Janeiro: ABEN - Associação Brasileira de Energia Nuclear, 2005. p. 1-6.
MACEDO, Rodrigo D´Alessandro. Vertebroplastia Associada 'a Braquiterapia para Tratametno de Neoplasias Malígnas ósseas da Coluna Vertebral. 2005. Dissertação (Mestrado em Ciências Técnicas Nucleares) - Universidade Federal de Minas Gerais, . Orientador: Tarcisio Passos Ribeiro de Campos.
PEÑA, J., e M. VALLET-REGÍ. “Hydroxyapatite, tricalcium phosphate and biphasic materials prepared by a liquid mix technique.” Journal of the European ceramic Society 23 (2003): 1687-1696.
RYU, Samuel, et al. “Partial volume tolerance of the spinal cord and complications of single-dose radiosurgery.” Cancer 109, nº 3 (2007): 628-636.
SILVEIRA, Márcia Flávia. Estudos para a viabilidade da técnica de radioosteoplastia através de simulações computacionais radiodosimétrica e de aplicações experimentais em ossos animais in vitro. Edição: Universidade Federal de minas Gerais. Vol. Dissertação. Belo Horizonte, Minas Gerais: UFMG, 2007.
TURNER, Thomas M., et al. “Vertebroplasty comparing injectable calcium phosphate cement compared with polymethylmetacrylate in a unique canine vertebral body large effect model.” The spine journal 8 (2008): 482-487.
VAN DER LINDEN, Yvette M, Sander P. D. S. DIJKSTRA, Ernest J. A. VONK, Corrie A. M. MARIJNEN, e Jan Willem H. LEER. “Prediction of survival in patients with metastases in the spinal column.” Cancer 103, nº 2 (January 2005): 320-328.
VIRTO, M. R., P. FRUTOS, Susana TORRADO, and G. FRUTOS. "Gentamicin release from modified acrylic bone cements with lactose and hydroxypropylmethylcellulose." Biomaterials 24 (2003): 79-87.
WEILL, A., J. CHIRAS, J. SIMON, M. ROSE, T. SOLA-MARTÍNEZ, e E. ENKAOUA. “Spinal Metastases: Indications for and Results of Percutaneous Injection of Acrylic Surgical Cement.” Radiology 199, nº 1 (1996): 241-247.